ไม่ได้ส่งคำตอบ
0.0
Ca(OCl)2(s) + 2H2O(l) $\rightarrow$ Ca(OH)2(s) + 2HOCl(aq) $\Delta$H1 = +113 kJ mol–1
4HOCl(aq) $\rightarrow$ 2H2O(l) + 2Cl2(g) + O2(g) $\Delta$H2 = –264 kJ mol–1
เรือบรรทุกสินค้าลำหนึ่งบรรทุกตู้คอนเทนเนอร์ซึ่งภายในมีถังขนาด 20.0 dm3 จานวน 100 ใบ ถังแต่ละใบบรรจุ Ca(OCl)2 ความบริสุทธิ์ 70% โดยน้าหนัก ความหนาแน่น 2.35 g cm–3 ปริมาณ 25.0 kg
ข้อมูล น้ำหนักโมเลกุลของสารต่าง ๆ ดังนี้ Ca(OCl)2 = 143, Ca(OH)2 = 74.1, Cl2 = 71.0, HOCl = 52.5, O2 = 32.0, H2O = 18.0
ค่าคงที่ของแก๊ส R = 0.0821 dm3 atm mol–1 K–1
คำถาม
1. จงคำนวณความร้อนที่เกิดขึ้นในถังแต่ละใบเมื่อ Ca(OCl)2 สลายตัวอย่างสมบูรณ์ (ตอบในหน่วย MJ และมีเศษทศนิยม 1 ตาแหน่ง)
2. หากความร้อนที่เกิดขึ้นทำให้อุณหภูมิภายในถังมีค่าเท่ากับ 500 K ความดันสุดท้ายภายในถังหนึ่ง ๆ ควรมีค่าเท่าใด เมื่อ Ca(OCl)2 สลายตัวอย่างสมบูรณ์ (ตอบในหน่วย atm และไม่ต้องมีเศษทศนิยม)
กำหนดให้ ปริมาตรรวมของของแข็งก่อนและหลังการสลายตัวมีค่าคงที่ และ จำนวนโมลของอากาศน้อยมากเมื่อเทียบกับแก๊สที่เกิดขึ้นจากการสลายตัว
ข้อกำหนดการตอบ ให้ตอบคำตอบข้อ 1. คั่นด้วยจุลภาค (,) แล้วตำมด้วยคำตอบข้อ 2. โดยไม่เว้นวรรค เช่น หากคำนวณได้ 20.25 MJ และ 42.2 atm ให้ตอบ 20.3,42 เป็นต้น
1 คำตอบ 2.3 MJ หรือ 2.4 MJ (ขึ้นกับการวิธีการคำนวณ)
วิธีคิด
เนื่องจากถังแต่ละใบบรรจุ Ca(OCl)2 ความบริสุทธิ์ 70% โดยน้ำหนัก ปริมาณ 25.0 kg ดังนั้นในถังแต่ละใบจะมี Ca(OCl)2 ปริมาณ 0.70×25.0×1000 g นั่นคือ มีจำนวนโมลของ Ca(OCl)2 เท่ากับ ![]()
ต่อมาให้พิจารณาสมการทีละขั้น คือ
ขั้นที่ 1: Ca(OCl)2(s) + 2H2O(l) $\rightarrow$ Ca(OH)2(s) + 2HOCl(aq) $\Delta$H1 = +113 kJ mol–1
จะเห็นได้ว่าเมื่อ Ca(OCl)2 จำนวน 1 โมลทำปฏิกิริยาจะมีการดูดความร้อน +113 kJ mol–1 ดังนั้นเมื่อมีจำนวนโมลของ Ca(OCl)2 เท่ากับ ![]() จะได้ว่าขั้นตอนนี้มีการดูดความร้อนเท่ากับ
จะได้ว่าขั้นตอนนี้มีการดูดความร้อนเท่ากับ
![]()
นอกจากนี้ยังเกิด HOCl (ซึ่งเป็นสารตั้งต้นของขั้นที่ 2) ปริมาณ ![]()
ขั้นที่ 2: 4HOCl(aq) $\rightarrow$ 2H2O(l) + 2Cl2(g) + O2(g) $\Delta$H2 = –264 kJ mol–1
จะเห็นได้ว่าเมื่อ HOCl จำนวน 4 โมลทำปฏิกิริยาจะมีการคายความร้อน –264 kJ mol–1 ดังนั้นเมื่อมีจำนวนโมลของ HOCl เท่ากับ ![]() จะได้ว่าขั้นตอนนี้มีการคายความร้อนเท่ากับ
จะได้ว่าขั้นตอนนี้มีการคายความร้อนเท่ากับ
![]()
ดังนั้น เมื่อรวมทั้ง 2 ขั้นจะได้ว่าเมื่อ Ca(OCl)2 ในแต่ละถังสลายตัวอย่างสมบูรณ์จะมีการคายความร้อนเท่ากับ ![]()
หมายเหตุ หากคำนวณอย่างย่อแล้วกดเครื่องคิดเลขเพื่อหาคำตอบสุดท้ายในคราวเดียวจะได้คำตอบเป็น ![]() ดังนี้
ดังนี้
วิธีคิดอย่างย่อ
ขั้นที่ 1: ![]() = +13.8 MJ
= +13.8 MJ
ขั้นที่ 2: ![]() = -16.2 MJ
= -16.2 MJ
รวมทั้งสองขั้น = -2.3 MJ
2 คำตอบ 805 atm
วิธีคิด
การคำนวณความดัน (\(\text{P}\)) ที่เกิดจากแก๊สสามารถคำนวณได้จากสมการของแก๊สอุดมคติ คือ \(\text{pV = nRT}\) โดยในที่นี้โจทย์ได้กำหนดอุณหภูมิ (\(\text{T}\)) ให้แล้ว ดังนั้นนักเรียนจะต้องหาจำนวนโมลของแก๊ส (\(\text{N}\)) และปริมาตรของแก๊ส (\(\text{V}\)) เพื่อที่จะคำนวณหา \(\text{P}\) โดย \(\displaystyle\text{P} = \frac{\text{nRT}}{\text{V}}\)
การหาจำนวนโมลของแก๊ส (n)
ปฏิกิริยาของขั้นที่ 1 ไม่มีผลิตภัณฑ์ที่เป็นแก๊ส ในขณะที่ปฏิกิริยาขั้นที่ 2
4HOCl(aq) $\rightarrow$ 2H2O(l) + 2Cl2(g) + O2(g)
มีผลิตภัณฑ์ที่เป็นแก๊สโดยที่ HOCl จำนวน 4 โมลจะทำให้เกิดผลิตภัณฑ์ที่เป็นแก๊สจำนวน 3 โมล (แก๊สคลอรีน 2 โมล และแก๊สออกซิเจน 1 โมล)
ดังนั้นเมื่อมี HOCl จำนวน ![]() จะมีแก๊สเกิดขึ้น
จะมีแก๊สเกิดขึ้น
![]() ซึ่งเท่ากับ
ซึ่งเท่ากับ ![]() (ทราบค่า \(\text{n}\))
(ทราบค่า \(\text{n}\))
*** ไม่ต้องคิดจำนวนโมลของอากาศเนื่องจากมีการกำหนดเอาไว้แล้วว่าจำนวนโมลของอากาศน้อยมากเมื่อเทียบกับแก๊สที่เกิดขึ้นจากการสลายตัว ***
การหาปริมาตรของแก๊ส (V)
ปริมาตรของแก๊ส คือ ปริมาตรที่ว่างของภาชนะ (ถัง) ที่แก๊สบรรจุอยู่ ดังนั้น
ปริมาตรที่ว่าง = ปริมาตรของถัง – ปริมาตรของของแข็งหลังการสลายตัว
ปริมาตรของถัง เท่ากับ 20.0 dm3 (โจทย์กำหนด)
ปริมาตรของของแข็งหลังการสลายตัวสามารถคำนวณได้จากน้ำหนักและความหนาแน่นของสารก่อนการสลายตัว (เนื่องจากมีการกำหนดเอาไว้ว่าปริมาตรรวมของของแข็งก่อนและหลังการสลายตัวมีค่าคงที่) ซึ่งมีค่าเท่ากับ 25.0 kg และ 2.35 g cm–3 ตามลำดับ ดังนั้นปริมาตรของของแข็ง เท่ากับ\(\displaystyle\frac{25.0 \ \text{kg}}{2.35 \ \text{kg dm}^{-3}}\)
*** หน่วย g cm–3 เท่ากับหน่วย kg dm–3 ***
ด้วยเหตุนี้ \(\text{V} = 20.0 \ \text{dm}^3 - \displaystyle\frac{25.0 \ \text{kg}}{2.35 \ \text{kg dm}^{-3}}\)
การคำนวณความดัน (P)
แทนค่า \(\text{n, V, T}\) ลงในสมการ \(\displaystyle\text{P} = \frac{\text{nRT}}{\text{V}}\) จะได้ว่า 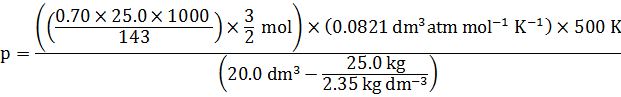
![]()
วิธีคิดอย่างย่อ
Vtotal – Vsolid = Vavailable
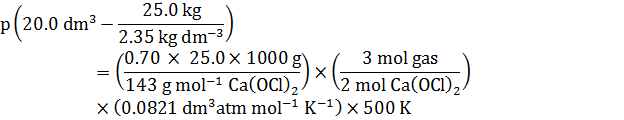
![]()